Al momento non esiste alcun farmaco in grado di prevenire, arrestare o guarire l’Alzheimer o le malattie legate alla demenza. L’Alzheimer è una malattia estremamente complessa dall’andamento progressivo. Poiché non sono ancora noti tutti i meccanismi biologici, lo sviluppo di farmaci per il trattamento è arduo. In tutto il mondo si conducono comunque da anni ricerche su varie sostanze attive per il trattamento del morbo di Alzheimer.
Ecco come si presenta la situazione attuale:
nel luglio del 2024, la Food and Drug Administration statunitense (FDA) ha autorizzato il principio attivo Donanemab negli Stati Uniti. Una domanda di autorizzazione è stata presentata anche all’Istituto svizzero per gli agenti terapeutici Swissmedic, che ancora non si è pronunciato in merito.
Al momento vi sono più di 100 diverse sostanze attive che sono oggetto di studi clinici. In questi studi, si misurano la sicurezza, il dosaggio, la tollerabilità e l’efficacia dei principi attivi in persone sane e in persone affette dal morbo di Alzheimer. Così facendo si perseguono diversi approcci al trattamento della malattia, puntando a numerosi meccanismi d’azione nel cervello.
I principi attivi studiati negli studi clinici sull’uomo possono essere divisi in tre gruppi. Il primo gruppo è composto da sostanze attive che trattano e alleviano i sintomi dell’Alzheimer. Hanno lo scopo di stabilizzare le prestazioni del cervello o di ridurre i disturbi comportamentali e dell’umore nei malati. Queste sostanze possono migliorare la qualità di vita delle persone affette da demenza e dei loro familiari, ma non mirano principalmente a trattare le cause biologiche dell'Alzheimer e quindi a fermare o curare la malattia.
Gli altri due gruppi perseguono invece l’obiettivo primario di modificare la biologia sottostante la malattia, rallentandola o, nel migliore dei casi, curandola. Si fa anche una distinzione tra i farmaci biologici, ottenuti da organismi viventi e somministrati, per esempio, come infusioni, e le piccole molecole, assunte per via orale.
Al giorno d'oggi, la maggior parte degli studi clinici sui principi attivi mira a influenzare i meccanismi alla base della malattia di Alzheimer. Così facendo si seguono diversi approcci nell’ambito della presunta patogenesi della malattia (video dell’Iniziativa sulla ricerca contro l’Alzheimer, in tedesco Alzheimer Forschung Initiative e.V.). Questi mirano, per esempio, a ridurre il deposito di proteina tau o beta-amiloide, al fine di prevenire i processi infiammatori o la morte delle cellule nervose nel cervello.
Fonti: Cummings, J., Lee, G., Zhong, K., Fonseca, J., & Taghva, K. (2021). Alzheimer's disease drug development pipeline: 2021. Alzheimer's & Dementia: Translational Research & Clinical Interventions, 7(1), e12179.
Vari composti per il trattamento del morbo di Alzheimer sono in una fase avanzata di sviluppo in tutto il mondo. Nei cosiddetti studi clinici di fase 3, la tollerabilità e l’efficacia delle sostanze attive vengono esaminate su diverse migliaia di partecipanti allo studio. Se un produttore può dimostrare con sicurezza il successo terapeutico di un principio attivo, l’autorizzazione all’immissione in commercio viene solitamente concessa.
In questa fase avanzata di sviluppo, la maggior parte dei principi attivi attualmente studiati sono anticorpi diretti contro i depositi di proteine nel cervello. In base alle conoscenze attuali, la malattia di Alzheimer è dovuta, tra l’altro, a questi depositi proteici nel cervello, i cosiddetti depositi di beta-amiloide (A?). Essi sono causati dall’accumulo e dal misfolding delle proteine, che successivamente vanno a formare molecole tossiche nel cervello. Ciò può provocare infiammazioni e la morte delle cellule. La somministrazione di anticorpi che attaccano i depositi di A? caratteristici della malattia ha lo scopo di ridurne o impedirne la formazione.
I principi attivi che seguono questo approccio sono il principio attivo Donanemab della casa farmaceutica americana Eli Lilly e il principio attivo conosciuto con i nomi di Lecanemab e BAN2401 della casa farmaceutica giapponese Eisai e dell’azienda partner statunitense Biogen.
Secondo un comunicato stampa pubblicato da Eli Lilly il 3 maggio 2023, il trattamento con il Donanemab in uno studio di fase 3 ha rallentato il deterioramento clinico del 35% rispetto al placebo e ha ridotto del 40% l’incapacità di svolgere le attività della vita quotidiana. Questo principio attivo è stato approvato negli Stati Uniti a luglio 2024. In Svizzera la decisione non è invece ancora stata presa.
Alla fine di novembre del 2022 le due aziende Eisai e Biogen hanno inoltre presentato risultati incoraggianti per il loro principio attivo Lecanemab. Il 6 gennaio 2023 questo farmaco è stato approvato negli USA. A giugno 2023, Eisai ha presentato una domanda di approvazione anche presso Swissmedic, l’Istituto svizzero per gli agenti terapeutici. Mentre il Comitato per i medicinali per uso umano dell’EMA ha dato il via libera al principio attivo Lecanemab nel novembre del 2024, la decisione in Svizzera è ancora in sospeso.
Alzheimer Europe offre una panoramica di tutti gli studi clinici in Europa sul tema della demenza.
Anche la Svizzera è coinvolta nella ricerca di farmaci per il trattamento del morbo di Alzheimer. Di recente è stata data particolare importanza all’ingrediente attivo denominato Gantenerumab della casa farmaceutica Roche, che è stato studiato in studi clinici di fase 3. Anche questo agente è un anticorpo che distrugge i depositi di A? nel cervello. Nelle analisi degli studi di fase 3 il Gantenerumab si è tuttavia dimostrato non sufficientemente efficace, anche a dosi elevate.
Il portale sulla ricerca sull’essere umano in Svizzera gestito dall’Ufficio federale della sanità pubblica fornisce una lista di tutti gli studi clinici condotti nel nostro paese.
Se un farmaco riceve l’autorizzazione all’immissione in commercio, sono necessari ulteriori passaggi prima che venga poi rimborsato. In Svizzera i farmaci sono rimborsati dall’assicurazione di base obbligatoria solo se sono prescritti da un medico e se sono inclusi nell’elenco delle specialità dell’Ufficio federale della sanità pubblica (UFSP).
Inserimento nell’elenco delle specialità
Perché un farmaco venga inserito nell'elenco delle specialità, l'azienda in questione deve presentare una domanda all'UFSP (cfr. fig. 1). Ciò può avvenire già durante la procedura di autorizzazione, a condizione che vi sia una decisione preliminare positiva da parte di Swissmedic, l’Istituto svizzero per gli agenti terapeutici in Svizzera. L’UFSP verifica in seguito se il farmaco soddisfa i cosiddetti criteri sgv, secondo i quali esso dev’essere efficace, appropriato ed economico. Durante questa procedura vengono presi in considerazione aspetti quali l’efficacia rispetto alle terapie esistenti e a lungo termine e la sicurezza. Per quanto riguarda l’appropriatezza, viene invece esaminata la necessità medica vigente in Svizzera, nonché gli aspetti etici o il possibile rischio di abuso. Il rapporto costo/efficacia e il prezzo del farmaco sono determinati tramite un confronto incrociato con i farmaci già autorizzati per il trattamento della stessa malattia e un confronto dello stesso farmaco in altri Paesi. Per questi ultimi, si prendono in considerazione i Paesi economicamente paragonabili alla Svizzera in termini di settore farmaceutico, come la Germania o la Svezia. Anche il rapporto costi-benefici e le conseguenze derivanti dai costi stessi giocano un ruolo nell’efficienza economica.
Nella sua valutazione, l’UFSP si avvale della consulenza della Commissione federale dei medicamenti (CFM). La procedura di ammissione richiede almeno 18 settimane, con una media di 200 giorni. Ciò significa che metà delle procedure richiede meno tempo, mentre l'altra metà richiede più di 200 giorni. Se un farmaco autorizzato è incluso nell’elenco delle specialità, viene rivisto ogni tre anni.
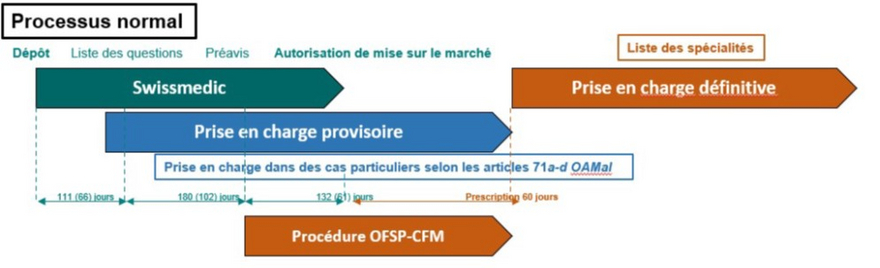
Illustrazione 1: inclusione nell'elenco delle specialità (Ufficio federale della sanità pubblica UFSP, Divisione Comunicazione e campagne, 2023)
Rimborso in casi speciali
Se un farmaco non rientra nell’elenco delle specialità, in genere non viene rimborsato dalla cassa malati. Tuttavia, in singoli casi eccezionali, può succedere che un rimborso venga comunque concesso. Affinché ciò avvenga deve venir rispettata almeno una delle condizioni indicate qui di seguito.
- Il farmaco ha un importante beneficio terapeutico contro una malattia che può essere fatale o comportare una grave e cronica compromissione della salute e al contempo non sono disponibili altri metodi di trattamento efficaci e autorizzati.
- Il farmaco è un prerequisito essenziale per la fornitura di un altro servizio fondamentale coperto dall’assicurazione malattia obbligatoria.
Questi casi eccezionali richiedono una richiesta alle casse malati, che poi negoziano un prezzo individuale per il farmaco.




![[Translate to Italiano:] [Translate to Italiano:]](/fileadmin/_processed_/3/b/csm_zahlenundfakten_79514e6b8c.jpg)