Lo sviluppo di un nuovo farmaco è un lungo cammino e la sperimentazione sugli esseri umani nei cosiddetti studi clinici ne costituisce solo la fase conclusiva. I primi risultati sono acquisiti sempre negli studi di laboratorio, che servono a esaminare le proprietà del nuovo principio attivo con la massima precisione al fine di rendere il più possibile sicuro il successivo impiego sulle persone.
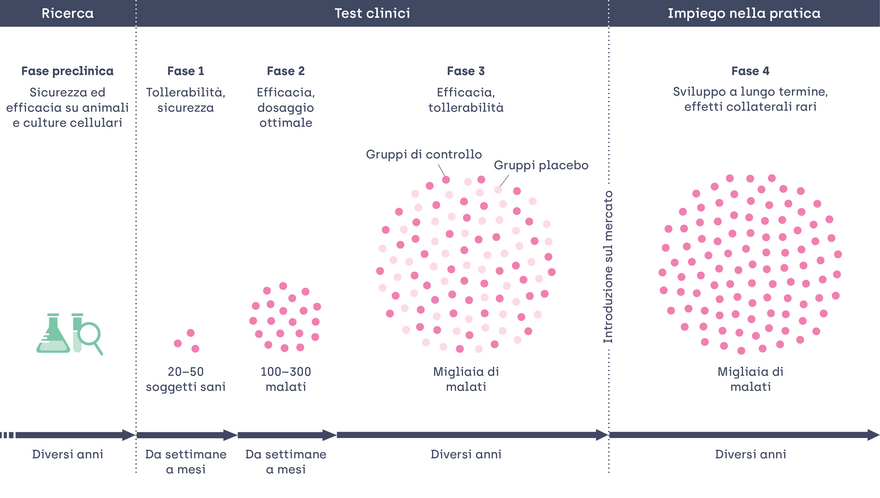
In questa fase gli studi si concentrano soprattutto sulle proprietà fisiche e chimiche del nuovo principio attivo. L’uso sugli esseri umani viene simulato conducendo esperimenti sugli animali o al giorno d’oggi, per quanto possibile, con le colture di cellule. In questo modo i ricercatori provano a comprendere a fondo l’azione del principio attivo sull’organismo umano e gli eventuali effetti collaterali. Elaborano anche le prime indicazioni per un possibile dosaggio.
Solo i principi attivi che risultano promettenti dopo questa serie di test condotti in laboratorio vengono sperimentati negli studi clinici sugli esseri umani. Ora può cominciare il secondo, importante stadio di sviluppo del farmaco.
Ma neppure il processo degli studi clinici si svolge in una sola fase, bensì consiste di quattro fasi l’una susseguente all’altra. Ogni fase deve evidenziare risultati che vanno nella direzione dell'effetto desiderato. Tali risultati costituiscono il criterio per proseguire la ricerca nella fase successiva.
- Gli studi di fase I sono generalmente studi ristretti, nei quali il nuovo principio attivo viene somministrato a volontari sani. In questo stadio i ricercatori studiano le proprietà fondamentali, tra cui la tollerabilità e la sicurezza di un nuovo farmaco. In tal modo verificano che sia indicato per l’uso negli esseri umani. Rispetto alle fasi successive dello studio, qui i rischi sono ancora piuttosto elevati poiché, fatta eccezione per i risultati di laboratorio, si conosce ancora poco del principio attivo. Di conseguenza, in questa fase i soggetti sui quali è condotto lo studio vengono sorvegliati assiduamente e sottoposti a controlli periodici.
- Gli studi di fase II coinvolgono già da 100 a 300 persone. In questo stadio l’attenzione si concentra per la prima volta sul gruppo di persone per il quale viene sviluppato il farmaco, nell’intento di trovare il dosaggio ottimale. Inoltre i ricercatori raccolgono i primi dati sull’efficacia rispondendo alle seguenti domande: il farmaco agisce come sperato? In caso affermativo, qual è il dosaggio necessario per ottenere questo effetto? Quali risposte avverse sono collegate ai diversi dosaggi?
- Gli studi di fase III sono studi di vasta portata, nei quali sono spesso coinvolte diverse migliaia di persone. Il loro obiettivo è ottenere risultati il più possibile attendibili sull’efficacia e la tollerabilità del principio attivo. A tal fine sono condotti confronti con un gruppo di controllo che riceve il placebo, ossia ad alcuni pazienti viene somministrato il principio attivo, mentre ad altri solo un trattamento fittizio. Né i ricercatori né i pazienti sono a conoscenza dell'assegnazione dei gruppi. Tale metodo, cosiddetto in doppio cieco, è particolarmente importante per ottenere una valutazione il più possibile obiettiva dell’efficacia. In questa fase vengono svolte valutazioni intermedie a intervalli predefiniti. Sulla base dei dati sin qui raccolti si decide se proseguire lo studio o sospenderlo. Normalmente viene interrotto se i risultati auspicati appaiono difficili da raggiungere oppure si verificano effetti collaterali molto pesanti. Di norma si giunge a un’omologazione solo se lo studio di fase III si conclude positivamente dimostrando l’efficacia e la tollerabilità del farmaco. Questa fase è dunque particolarmente importante e deve essere condotta con grande rigore. La sfida consiste spesso soprattutto nella difficoltà di trovare volontari che partecipano allo studio e rispondono ai necessari criteri. A seconda della malattia, come nel caso del morbo di Alzheimer, questa fase può durare diversi anni.
- Gli studi di fase IV vengono condotti quando un farmaco è già sul mercato. In questo stadio può essere opportuno studiare in modo mirato un farmaco già omologato per accertarne gli effetti a lungo termine e le rare reazioni avverse possibili. Anche questa fase coinvolge un numero elevato di pazienti e può durare diversi anni. L’FDA, l’autorità statunitense preposta al controllo dei farmaci, ha posto come condizione che venisse condotto questo studio di fase IV per il nuovo farmaco contro l’Alzheimer.
![[Translate to Italiano:] [Translate to Italiano:]](/fileadmin/_processed_/3/b/csm_zahlenundfakten_aee0255081.jpg)
[Translate to Italiano:]


