Le développement d’un nouveau médicament prend beaucoup de temps. Les essais cliniques, qui correspondent à l’expérimentation chez l’être humain, n’interviennent qu’à la fin du processus. Les premiers résultats sont toujours obtenus lors d’études en laboratoire, qui visent à examiner scrupuleusement les propriétés du nouveau principe actif, en vue de garantir la sécurité maximale de son utilisation ultérieure chez l’Homme.
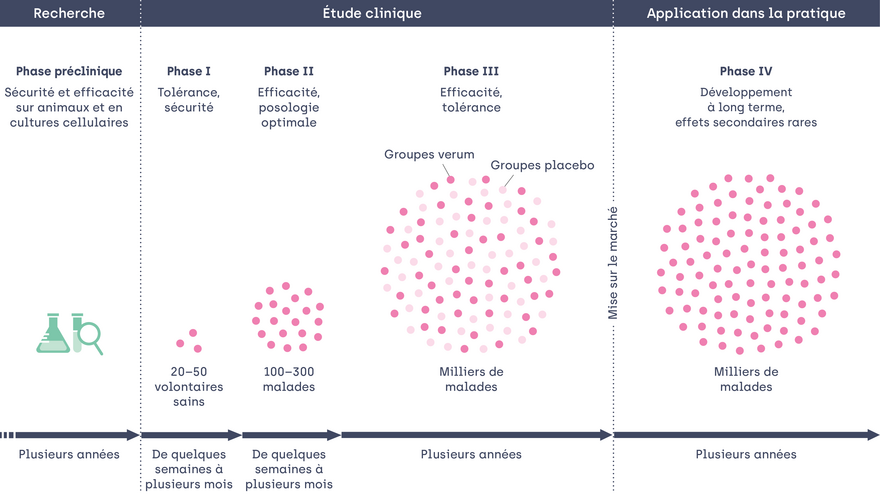
Ces études se concentrent essentiellement sur les propriétés physiques et chimiques de la nouvelle molécule. L’expérimentation animale, et aujourd’hui les cultures de cellules dans la mesure du possible, simulent l’utilisation sur l’être humain. Les chercheur·euses tentent ainsi d’évaluer au mieux les effets de la substance sur l’organisme humain ainsi que ses effets secondaires éventuels, et d’émettre les premières recommandations quant à un dosage envisageable.
Seules les molécules qui s’avèrent prometteuses lors de cette série de tests font ensuite l’objet d’essais cliniques sur des sujets humains. Le médicament peut alors entamer la deuxième phase de son développement.
Les études cliniques ne se limitent pas non plus à une seule étape. Le processus comprend quatre phases successives, qui doivent chacune présenter des résultats positifs en termes d’effets désirés, pour pouvoir passer à la phase suivante :
- Les études de phase I sont généralement des essais réalisés sur un petit groupe de volontaires sains. À ce stade, les chercheur·euses évaluent les propriétés de base d’un nouveau médicament, notamment son innocuité et sa tolérance. Ils vérifient ainsi si son utilisation est indiquée pour l’être humain. Les risques, par rapport aux phases d’études ultérieures, sont relativement élevés à ce stade, car il existe très peu d’informations sur la molécule autres que les résultats de laboratoire. Les volontaires qui participent aux études sont donc surveillés de très près et font l’objet de contrôles réguliers.
- Les études de phase II regroupent déjà entre 100 et 300 participant·es. C’est à ce stade qu’est impliqué pour la première fois le groupe de personnes pour lequel le médicament est développé. Il s’agit ici de trouver le dosage optimal. Les chercheur·euses récoltent en outre les premières données concernant l’efficacité de la molécule. Ils cherchent notamment à savoir si le médicament produit l’effet escompté, à connaître le dosage à partir duquel cet effet est obtenu ainsi que les effets secondaires associés aux différents dosages.
- Les études de phase III sont des essais de grande envergure qui regroupent souvent plusieurs milliers de participant·es. Leur objectif est d’apporter des connaissances les plus étayées possibles sur la tolérance et l’efficacité du principe actif. Elles consistent à comparer des « groupes placebo » et des « groupes témoin », ce qui signifie que certains groupes reçoivent le traitement et d’autres uniquement un pseudo-médicament. Ni les chercheur·euses, ni les participant·es ne savent qui appartient à quel groupe, cette condition étant capitale pour que l’évaluation de l’effet soit la plus objective possible. Pendant cette phase, des évaluations intermédiaires ont lieu à des intervalles définis. À la lumière des données obtenues, la décision est prise de poursuivre ou de stopper l’étude. Celle-ci est généralement interrompue si l’obtention des effets escomptés est peu probable ou que des effets indésirables très importants se manifestent. Ce n’est que lorsque l’étude de phase III s’est achevée avec succès et que l’efficacité et la tolérance ont été prouvées qu’il est en général possible d’obtenir une autorisation de mise sur le marché. Cette phase est donc décisive et doit être menée avec le plus grand soin. L’enjeu consiste le plus souvent à rassembler suffisamment de volontaires qui répondent aux critères. Selon les maladies, cette phase peut durer plusieurs années, ce qui est le cas pour Alzheimer.
- Les études de phase IV sont réalisées une fois le médicament commercialisé. Il peut en effet s’avérer utile d’effectuer de nouvelles analyses sur un médicament déjà autorisé pour connaître ses effets à long terme et ses éventuels effets indésirables rares. Cette phase repose sur un grand nombre de participant·es et peut à nouveau durer plusieurs années. La FDA, l’autorité américaine de contrôle des médicaments, a imposé une telle étude pour le nouveau médicament contre la maladie d’Alzheimer.
![[Translate to Français:] [Translate to Français:]](/fileadmin/_processed_/3/b/csm_zahlenundfakten_aee0255081.jpg)
[Translate to Français:]


