Il n’existe actuellement aucun médicament en mesure de prévenir, de stopper ou de guérir la maladie d’Alzheimer ou toute autre forme de démence. La maladie d’Alzheimer est une pathologie extrêmement complexe et évolutive. Les mécanismes biologiques de cette dernière n’étant pas encore tous connus à ce jour, le développement de traitements médicamenteux s’avère difficile. Depuis de nombreuses années, plusieurs substances actives destinées au traitement de la maladie d’Alzheimer font l’objet de recherches dans le monde entier.
Actualités
En juillet 2024, l’agence américaine de surveillance des médicaments FDA aautorisé le principe actif donanemab aux États-Unis. En août 2024, l’agence britannique de réglementation des médicaments et des produits de santé (MHRA) a autorisé la commercialisation du lecanemab dans le traitement de la maladie d’Alzheimer à un stade précoce. Une demande d’autorisation pour ce principe actif a également été déposée auprès de l’Institut suisse des produits thérapeutiques Swissmedic. En Suisse, la décision est encore en suspens.
En novembre 2024, le Comité des médicaments à usage humain de l’AEM a donné son feu vert à la substance active lecanemab. En Suisse, la décision est encore en suspens.
Plus de 100 substances actives différentes font actuellement l’objet d’études cliniques portant sur la sécurité, le dosage, la tolérance et l’efficacité de ces substances chez des personnes saines et chez d’autres atteintes de la maladie d’Alzheimer. Plusieurs approches de traitement visant différents mécanismes d’action dans le cerveau sont suivies dans cette optique.
Les substances actives examinées chez l’être humain dans le cadre d’études cliniques peuvent être réparties en trois groupes. Le premier groupe se compose de substances actives qui traitent et atténuent les symptômes de la maladie d’Alzheimer. Elles visent soit à stabiliser les fonctions cérébrales, soit à réduire les troubles du comportement et de l’humeur de la personne malade. Ces substances actives peuvent améliorer la qualité de vie des personnes atteintes de démence et de leurs proches. Cependant, elles n’ont pas pour objectif premier de traiter les causes biologiques de la maladie d’Alzheimer et donc de stopper ou de guérir une pathologie.
Viennent ensuite les deux autres groupes dont le principal objectif est de modifier la biologie sous-jacente de la maladie. Cette modification vise à ralentir ou, dans le meilleur des cas, à guérir la maladie. On distingue en outre les « produits biologiques », autrement dit les substances actives extraites d’organismes vivants et administrées sous forme de perfusion par exemple, et les « petites molécules » qui sont généralement administrées par voie orale.
Aujourd’hui, la plupart des études cliniques sur les substances actives visent à influencer les mécanismes sous-jacents de la maladie d’Alzheimer. Différentes approches sont suivies dans le cadre de l’origine supposée de la maladie (vidéo d’Alzheimer Forschung Initiative e. V. à ce sujet en allemand). Celles-ci aspirent notamment à réduire les dépôts de protéines Tau ou de bêta-amyloïde, à empêcher les processus inflammatoires qui en résultent ou la destruction des cellules nerveuses dans le cerveau.
Sources : Cummings, J., Lee, G., Zhong, K., Fonseca, J., & Taghva, K. (2021). Alzheimer's disease drug development pipeline: 2021. Alzheimer's & Dementia: Translational Research & Clinical Interventions, 7(1), e12179.
À l’échelle mondiale, plusieurs substances actives destinées au traitement de la maladie d’Alzheimer se trouvent à un stade avancé de développement. Dans les études cliniques dites de phase III, la tolérance et l’efficacité des substances actives sont examinées sur plusieurs milliers de participants. Si un fabricant parvient à démontrer le succès thérapeutique d’une substance active, l’autorisation de mise sur le marché est généralement accordée.
À un stade avancé de développement, la plupart des substances actives étudiées sont des anticorps dont l’action est dirigée contre les dépôts de protéines dans le cerveau. Selon l’état actuel des connaissances, la maladie d’Alzheimer est notamment due à ces dépôts de protéines dans le cerveau, appelés dépôts de bêta-amyloïde (A?). Ces dépôts résultent de l’accumulation et du repliement anormal des protéines dans le cerveau, qui forment ensuite des molécules toxiques pouvant entraîner une inflammation et la destruction des cellules nerveuses. L’administration d’anticorps ciblant ces dépôts de bêta-amyloïde dans le cerveau, caractéristiques de la maladie, pourrait permettre de les réduire ou d’empêcher leur apparition. Les substances actives qui suivent cette approche sont notamment le « donanemab », développé par l’entreprise pharmaceutique américaine Eli Lilly, ainsi que le principe actif connu sous les noms de lecanemab et BAN2401 de l’entreprise pharmaceutique japonaise Eisai et de son partenaire Biogen.
Selon le communiqué de presse publié par Ely Lilly le 3 mai 2023, l’étude clinique de phase III a montré une réduction de 35 % du déclin cognitif et fonctionnel des patients traités avec le donanemab. Par ailleurs, les participants à l’étude ont présenté une réduction de 40 % du déclin dans leur capacité à réaliser des activités de la vie quotidienne. Ce principe actif a été autorisé en juillet 2024 aux États-Unis. En Suisse, la décision est encore en suspens.
Fin novembre 2022, les deux entreprises Eisai et Biogen ont en outre présenté des résultats encourageants sur le principe actif lecanemab. Le 6 janvier 2023, ce dernier a été autorisé aux États-Unis. En juin 2023, Eisai a déposé une demande d’autorisation pour ce principe auprès de Swissmedic, l’Institut suisse des produits thérapeutiques. Alors que le Comité des médicaments à usage humain de l’AEM a donné son feu vert à la substance active lecanemab en novembre 2024, la Suisse doit encore se prononcer sur la question.
Alzheimer Europe fournit un aperçu de toutes les études cliniques menées en Europe sur les démences.
La Suisse participe également à la recherche de médicaments pour le traitement de la maladie d’Alzheimer. Dernièrement, une attention particulière avait été accordée à la substance active du nom de « gantenerumab » du groupe pharmaceutique Roche, qui avait fait l’objet d’études cliniques de phase 3. Il s’agissait également d’un anticorps dirigé contre les dépôts de bêta-amyloïde dans le cerveau. Cependant, lors des évaluations des études de phase III, le gantenerumab s’est révélé trop peu efficace, même à haute dose.
Le portail dédié à la recherche sur l’être humain en Suisse de l’Office fédéral de la santé publique donne un aperçu de toutes les études cliniques menées en Suisse.
Lorsqu’un médicament obtient l’autorisation de mise sur le marché, d’autres étapes sont encore nécessaires avant qu’il ne soit remboursé. En Suisse, les médicaments ne sont remboursés dans le cadre de l’assurance de base obligatoire que s’ils sont prescrits par un médecin et s’ils figurent sur la liste des spécialités de l’Office fédéral de la santé publique (OFSP).
Admission sur la liste des spécialités
Pour qu’un médicament puisse être inscrit sur la liste des spécialités, l’entreprise concernée doit déposer une demande auprès de l’OFSP (cf. fig. 1). Cela peut déjà se faire durant la procédure d’autorisation, pour autant que Swissmedic, l’autorité suisse d’autorisation et de surveillance des produits thérapeutiques, ait émis un préavis positif. Ensuite, l’OFSP vérifie si le médicament répond aux critères EAE qui stipulent que le médicament doit être à la fois efficace, approprié et économique. Par ailleurs, des aspects tels que l’efficacité par rapport aux thérapies existantes, l’efficacité à long terme et la sécurité sont pris en compte. En ce qui concerne l’adéquation d’un médicament, on examine entre autres les besoins médicaux pour la Suisse, mais également les aspects éthiques ou le risque éventuel d’abus. Le caractère économique du médicament est évalué à l’aide d’une comparaison avec d’autres médicaments déjà autorisés et utilisés pour le traitement de la même maladie ainsi qu’avec la moyenne des prix du même médicament pratiqués dans les pays de référence. Pour procéder à cette dernière comparaison, on prend en compte les pays qui sont économiquement comparables à la Suisse en ce qui concerne le secteur pharmaceutique, comme par exemple l’Allemagne ou la Suède. Le rapport coût-efficacité et les conséquences financières du médicament jouent également un rôle important dans la rentabilité.
La Commission fédérale des médicaments (CFM) conseille l’OFSP lorsqu’il évalue les préparations originales. La procédure d’admission dure au moins 18 semaines, la durée moyenne étant de 200 jours, ce qui signifie que la moitié des procédures durent moins longtemps, tandis que l’autre moitié prend plus de 200 jours. Une fois qu’un médicament est admis dans la liste des spécialités, il est réexaminé tous les trois ans.
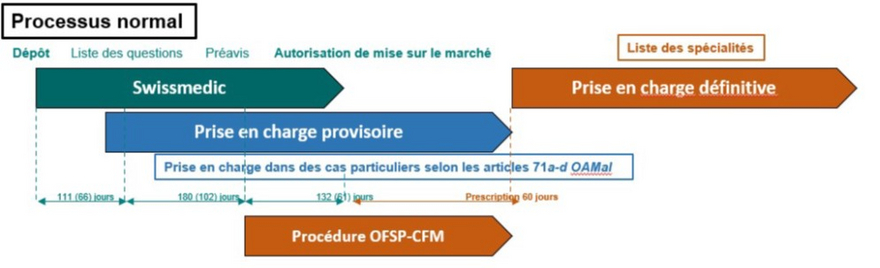
Figure 1 : inscription sur la liste des spécialités (Office fédéral de la santé publique OFSP, division Communication et campagnes, 2023).




![[Translate to Français:] [Translate to Français:]](/fileadmin/_processed_/3/b/csm_zahlenundfakten_79514e6b8c.jpg)