Die Entwicklung eines neuen Medikaments ist ein langer Weg. Erst als letzter Schritt steht die Erprobung am Menschen in den sogenannten klinischen Studien. Zuerst werden immer in Laborstudien die ersten Erkenntnisse gewonnen. Sie dienen dazu, die Eigenschaften des neuen Wirkstoffs möglichst genau zu untersuchen, um einen späteren Einsatz am Menschen möglichst sicher zu gestalten.
Im Zentrum stehen vor allem die physikalischen und chemischen Eigenschaften des neuen Wirkstoffs. Mit Tierexperimenten oder heute wo immer möglich mit Zellkulturen wird der Einsatz am Menschen simuliert. So versuchen die Forschenden möglichst gut abzuschätzen, wie der Wirkstoff auf den menschlichen Körper wirkt und welche Nebenwirkungen möglicherweise auftreten können. Sie erarbeiten auch erste Hinweise auf eine mögliche Dosierung des Wirkstoffes.
Nur Wirkstoffe, welche aus dieser Reihe von Labortests als vielversprechend hervorgehen, werden im Anschluss in den klinischen Studien an Menschen untersucht. Das zweite wichtige Stadium der Medikamentenentwicklung kann starten.
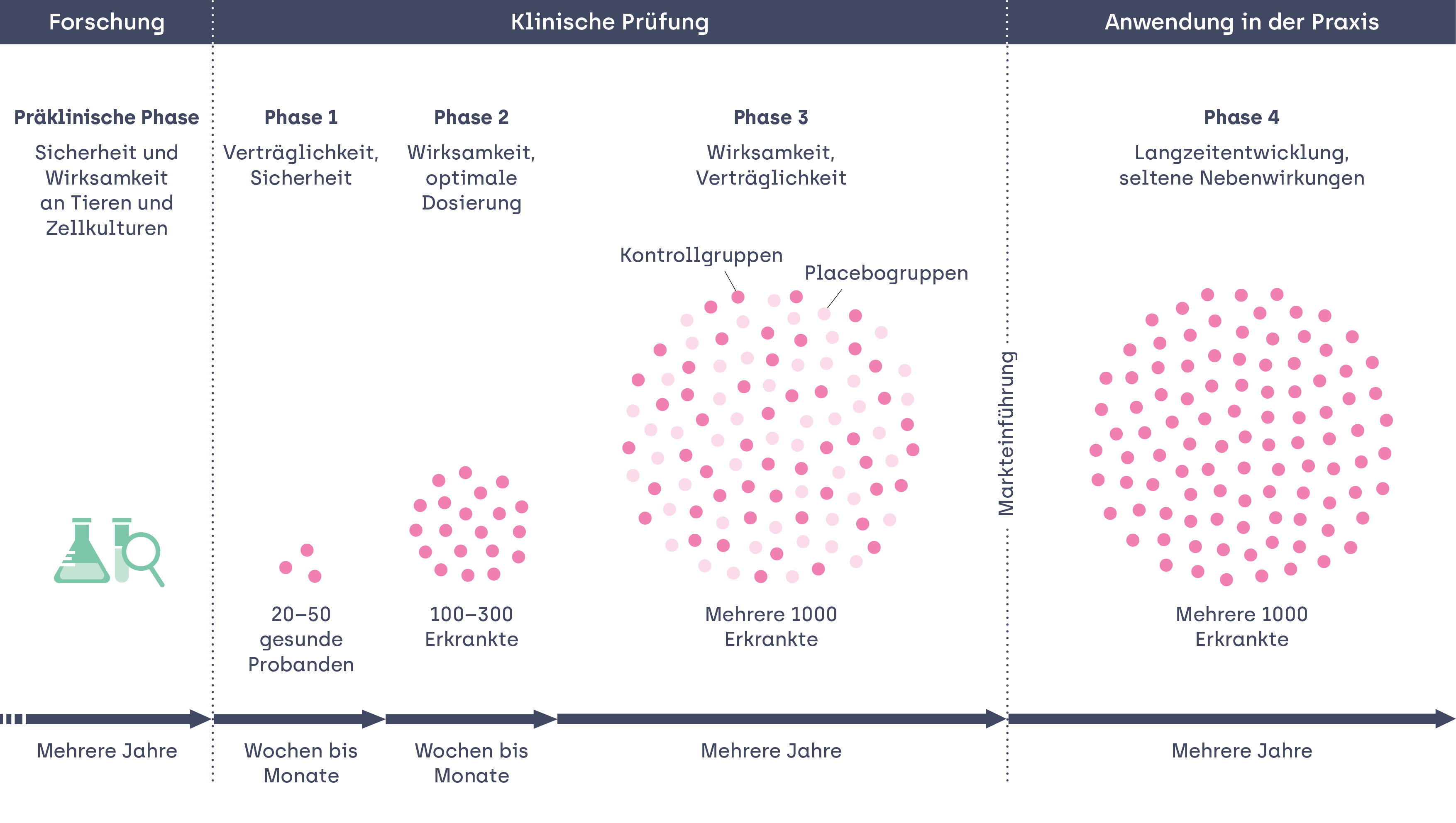
Aber auch der Prozess der klinischen Studien erfolgt nicht in einem Schritt. Er besteht aus vier aufeinander aufbauenden Phasen. Jede Phase muss positive Ergebnisse im Sinne des erwünschten Effekts aufweisen. Sie bilden das Kriterium, um in der nächsten Phase weiter zu forschen:
Phase I-Studien sind in der Regel kleine Studien, in denen der neue Wirkstoff an gesunden Freiwilligen eingesetzt wird. In diesem Stadium untersuchen die Forschenden grundlegende Eigenschaften wie Verträglichkeit und Sicherheit eines neuen Medikaments. So überprüfen sie, ob sich der Einsatz beim Menschen eignet. Im Vergleich zu späteren Studienphasen sind hier die Risiken relativ hoch, da ausser den Laborergebnissen noch sehr wenig über den Wirkstoff bekannt ist. Entsprechend werden die Proband*innen in dieser Studienphase besonders intensiv überwacht und regelmässig kontrolliert.
Phase II-Studien beziehen bereits 100 bis 300 Proband_innen ein. Hier steht zum ersten Mal die Personengruppe im Zentrum, für die das Medikament entwickelt wird. Dabei geht es um die optimale Dosierung. Zusätzlich erheben die Forschenden erste Daten zur Wirksamkeit. Sie gehen den Fragen nach: Wirkt das Medikament wie gewünscht? Wenn ja, wie viel davon ist nötig, um diese Wirkung zu erzielen? Welche Nebenwirkungen sind mit den unterschiedlichen Dosierungen verbunden?
Phase III-Studien sind grosse Studien, in die oft mehrere 1000 Proband_innen einbezogen werden. Ihr Ziel ist, möglichst belastbare Erkenntnisse über Wirksamkeit und Verträglichkeit des Wirkstoffs zu erbringen. Hierfür werden sogenannten «Placebo-» oder «Kontrollgruppen» Vergleiche durchgeführt. Das bedeutet, einige Patient_innen erhalten den Wirkstoff und andere nur ein Scheinmedikament. Weder die Forschenden noch die Proband_innen wissen, in welcher Gruppe sie sind. Dies ist besonders wichtig, damit eine Beurteilung der Wirkung möglichst objektiv erfolgen kann. Während dieser Phase finden in definierten Abständen Zwischenauswertungen statt. Anhand der bis dahin gewonnen Daten wird entschieden, ob die Studie weitergeführt oder gestoppt wird. Abgebrochen wird in der Regel, wenn die gewünschten Ergebnisse unwahrscheinlich zu erreichen oder die auftretenden Nebenwirkungen sehr gross sind. Erst wenn die Phase III-Studie erfolgreich abgeschlossen und sowohl Wirkung wie Verträglichkeit nachgewiesen ist, kann in der Regel eine Zulassung erfolgen. Diese Phase ist daher besonders wichtig und muss mit grosser Sorgfalt durchgeführt werden. Die Herausforderung besteht häufig vor allem auch darin, ausreichend den Kriterien entsprechende freiwillige Studienteilnehmende zu finden. Je nach Erkrankung kann diese Phase wie bei der Alzheimer-Krankheit mehrere Jahre dauern.
Phase IV-Studien finden statt, wenn ein Medikament bereits auf dem Markt ist. Dann kann es sinnvoll sein, ein bereits zugelassenes Medikament noch einmal gezielt bezüglich seiner Langzeitwirkung und möglichen seltenen Nebenwirkungen zu untersuchen. Dies Phase bezieht entsprechend viele Patient_innen ein und kann erneut mehrere Jahre dauern. Die US-Zulassungsbehörde FDA forderte eine solche Phase-IV Studie für das neue Alzheimer-Medikament als Auflage.